En el saber popular la genómica es algo cuasi-divino, en las películas, la tele incluso entre muchos científicos, se pensaba que la secuenciación del genoma sería una panacea a todas nuestras dudas. Pero la realidad fue bien distinta, el genoma secuenciado ayudó muchísimo a los científicos y ha tenido multitud de consecuencias directas sobre nuestra vida, pero me atrevería a decir que son más las preguntas que nos ha generado que las respuesta que nos ha dado.
Tras tener en la mano una inmensa lista de letras desordenadas, se empezó a pensar en nuevas ciencias, las llamada "-omicas" una de ellas, la proteómica.
Inicialmente la forma de ver "qué" hacía la proteína era mutarla mediante mutagénesis dirigida o sobre-expresión. Con ello unas veces la célula interrumpía su ciclo, moría o cualquier otra cosa... Pero eran muchas las proteínas que no hacían "nada"
Para estos casos se empezaron a usar distintas técnicas para ver con quién interactuaban estas proteínas. Algunas de estas técnicas:
-Cromatografía por afinidad:
Consiste en sobre-expresar una proteina y después pasarla por un extracto celular para ver con qué interacciona. Tiene bastantes problemas, para empezar asumimos una enorme cantidad de proteína que no existen en condiciones normales. Además al lisar la célula la proteína quizás termine interactuando con proteínas a las cuales no tendría acceso in vivo.
-Co-inmuno precipitación (CO-IP):
Esta técnica es in vivo al contrario que la anterior. Asumiendo que las interaccones dentro de la célula no se crean "de novo". Se aplica un anticuerpo contra la proteína que estemos estudiando, hacemos un lisado celular y posteriormente "pescamos" el anticuerpo esperando que con él vengan la proteína a estudiar y alguna más pegada a ella. El problema de este método es la poca cantidad de material que obtenemos.
Sistema del doble híbrido en levaduras.
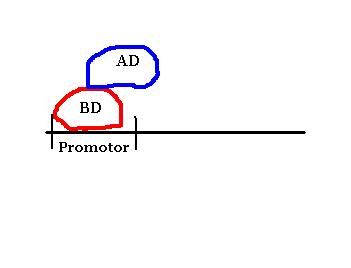
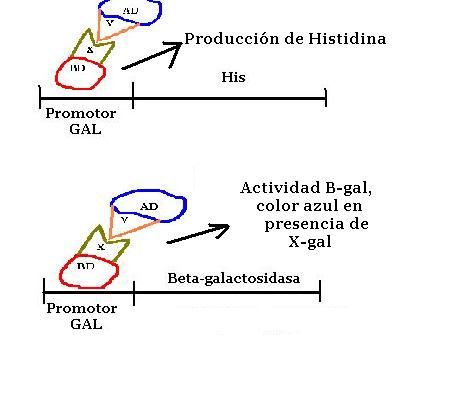
Método del que hablaremos con más profundidad en esta entrada. Es un método que aunque artificial, por usar proteínas bacterianas sobre levaduras (eucariotas), es in vivo. Se basa en el uso de factores de transcripción. Estos factores de transcripción suelen tener dos dominios, el activation domain (AD) o dominio de activación de la transcripción, y el binding domain (BD) o dominio de unión al ADN. De estos dos, el verdaderamente específico es el BD, el cual se une a genes promotores de los mensajeros.
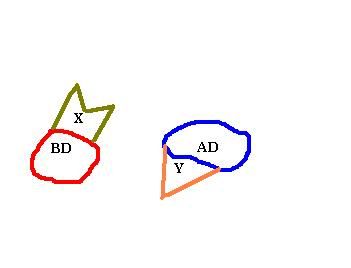
Para comenzar separaremos AD de BD, después construiremos el primer híbrido será BD del activador GAL4 y la proteína X . El segundo híbrido será el dominio AD de GAL4 y la proteína Y.
BD y AD separados no son capaces de mostrar transcripción, necesitan estar unidos. Esta característica es la que usaremos para el ensayo si la proteina X e Y se reconocen se unirán y se volverá a producir transcripción, confirmando que ambas proteinas están relacionadas.
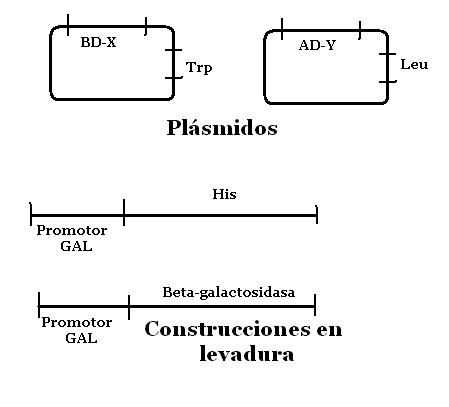
El siguiente paso consistirá en codificar plásmidos que posean estos complejos, BD-X y AD-Y. Además en cada plásmido se incluirá información para codificar un aminoácido. Triptófano y leucina en nuestro caso.
Usaremos una cepa modificada de Saccharomyces cerevisiae axótrofa para Triptófano, Leucina e histidina. Además debe carecer de promotores factores para Gal. Esta cepa incluye en su genoma dos construcciones indicadoras. El gen de levadura his3 y el bacteriano LacZ. Bajo el control de un promotor dependiente de GAL4
Después de ayudar a las levaduras a incorporar los dos plásmidos, cultivaremos para seleccionarlas en un medio sin leucina ni triptófano. Y las que crezcan estarán listas para las distintas pruebas.
Si no has entendido demasiado no te preocupes, vamos a hacer un pequeño resumen de lo dicho. Nuestra levadura es incapaz de producir por si misma aminoácidos fundamentales como son la histidina, triptófano y leucina. Para que se desarrolle debemos incluir estos aminoácidos en el medio en el cual se desarrollan. Como queremos comprobar que nuestras dos proteínas (X e Y) interactúan las incluimos a cada una en un plásmido, el cual también lleva la información necesaria para la síntesis de leucina y triptófano.
Para seleccionar levaduras que tengan ambos plásmidos, las cultivaremos en un medio sin, leucina ni triptófano. Con esto conseguiremos que sólo sobrevivan las que son capaces de producir su propia leucina y tríptofano es decir, las que han captado del medio los dos plásmidos. Estos plásmidos a su vez poseen BD y AD unidos a X e Y. Así que en cuanto la levadura empiece a usar el plásmido para producir los aminoácidos, también producirá los dos híbridos. Y aquí viene lo fundamental del experimento:
A nuestras supervivientes las sembraremos en un medio sin histidina, recordamos que en su propio genoma la levadura posee la información para producir su propia histidina, sin embargo el promotor es la llave para su producción, y este promotor sólo funciona bajo el sistema de transcripción GAL4 formado por BD y AD. Cómo dijimos para que AD y BD funcionen deben estar pegadas y sólo se pegaran si X e Y son proteínas que interaccionen. Ergo las bacterias que sobrevivan en un medio sin histidina confirmarán que los híbridos interaccionan.
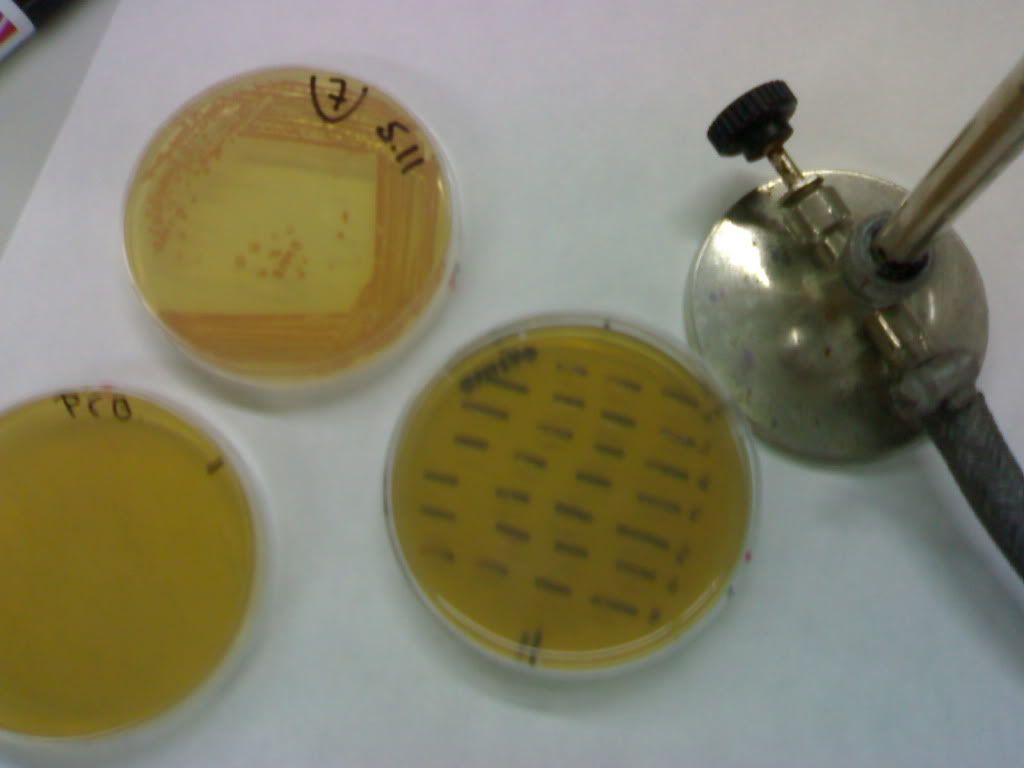
Aún así tenemos un segundo control, este se basa en la actividad beta-galactosidasa. Como decíamos al principio nuestras levaduras incorporan una construcción de origen bacteriano controlada por el mismo sistema GAL4 del que hablabamos antes. La actividad de esta enzima es visible, pues vuelve azul a la X-Gal. Por ello si hacemos el experimento, y vemos actividad Beta-galactosidasa, es decir que el medio se torna azul, confirmaremos que tanto X como Y interaccionan entre si.
Es importante decir que esta técnica permite comprobar intensidad de unión midiendo la actividad beta-galactosidasa, también permite mediante mutaciones puntuales encontrar el sitio exacto de unión de las distintas proteínas e incluso comprobar genotecas al completo, para ello sólo debemos cultivar la proteína a estudiar con BD, y luego cultivar en medio sin triptófano. Así a las que hayan captado el plásmido se le incluirá todo el banco de genes y se cultivarán en medio sin leucina, triptófano e histidina. Sólo sobreviviran las que consigan unión entre BD y AD, y con ello mediante electroforesis veremos cuales proteínas del genoma interaccionan con la proteína objetivo.
De todas formas este sistema también tiene un problema, y es que muchas proteínas sufren modificaciones tras ser sintetizadas, modificaciones que no es capaz de realizar la levadura. Por lo cual proteínas que interactuarían en muchos organismos, no lo hacen en experimentos.
Esto no es un protocolo requiere bastantes más datos, tampoco termina de ser una entrada divulgativa, por ser quizás demasiado técnica. Pero si habéis llegado hasta aquí y habéis leido anteriormente la entrada sobre plásmidos seguro que entendéis la mayor parte de lo ducho. Y sino siempre podéis preguntar/criticar, que con gusto os respondo.
En el caso que uséis esta entrada como repaso para el examen práctico de microbiología aplicada, os aconsejo repasar el tema de los controles negativos y positivos del ensayo. Ya que es un tema fundamental y del que no hablo.

JAJAJA mira quien es, yo ya hacía tiempo que leia tu blog, ademas fue desde que lo lei lo que me incentivo a hacerlo, ya que uno que comence hace varios años no lo publicaron.
ResponderEliminarA ver si te veo el la facultad y te digo quien soy, seguramente mañana en micro aplicada.
Un saludo.
Se me olvidaba, paint + bacterias si, es dificil encontar imagenes que expresen exactamente lo que tu quieres. siempre lo hacia en los informes pero la idea de ponerlo de esa manera en el blog te lo debo a ti, resulta mas vistoso y gracioso.Xau
ResponderEliminarEsta semana no creo que me veas por allí, que tengo las tardes ocupadas, pero a la siguiente seguro. Cómo dicen por ahí siempre es una alegría servir de inspiración.
ResponderEliminarsi, debe se ser en cursiva, pero el problema es que aun me tengo que pelear con el teclado para escribir y solo subo articulos o bien informes que ya haya hecho para subir las visitas. Estoy en periodo de entrenamiento y pruebas jajaja.
ResponderEliminaruna preguntita, cambiasteis el orden de las estirpes en tu practica, en nuestro grupo la actividad B-galactosidasa estaban en las estirpes 3 y 5.
ResponderEliminarSi, el autor de la placa sembró la 3 en el sitio de la 1. Pero la foto es simplemente para ver el "azul"
ResponderEliminarHola. Estoy realizando este ensayo en placa utilizando como marcador X-Gal, sin embargo he tenido problemas para obtener resultados. ¿Conoces alguna fuente donde pueda encontrar la metodología?
ResponderEliminarMejor que busques en artículos, en la parte de materiales y métodos. Siento no poder ayudarte.
EliminarFELICIDADES ES BUENA EXPLICACIÓN
ResponderEliminarHola Raven, muchas gracias por tu explicación. Me gustaría saber si se puede comprobar si la proteína X puede interaccionar con varias proteínas Y,Z,A.... en el mismo ensayo, es decir que el plásmido presa contenga a los genes que codifican para Y,Z,A....si no es posible, ¿sería necesario preparar varios plásmidos presa (cada uno con su proteína diferente)?
ResponderEliminar